您现在的位置是: 首页 > 教育科技 教育科技
氧化还原反应配平高考题-氧化还原反应配平高考
tamoadmin 2024-08-20 人已围观
简介1.请问氧化还原反应得失电子怎么配平?最好有图表达2.氧化还原反应方程式配平3.氧化还原反应方程式的配平4.配平氧化还原反应方程式的方法5.高中化学氧化还原反应配平问题请问氧化还原反应得失电子怎么配平?最好有图表达(1)氧化还原反应配平---得失电子法!(2) FeSO4 + KMnO4 + H2SO4 ==> Fe2(SO4)3 + K2SO4 + MnSO4 + H2O(3)氧化反应 2
1.请问氧化还原反应得失电子怎么配平?最好有图表达
2.氧化还原反应方程式配平
3.氧化还原反应方程式的配平
4.配平氧化还原反应方程式的方法
5.高中化学氧化还原反应配平问题
请问氧化还原反应得失电子怎么配平?最好有图表达
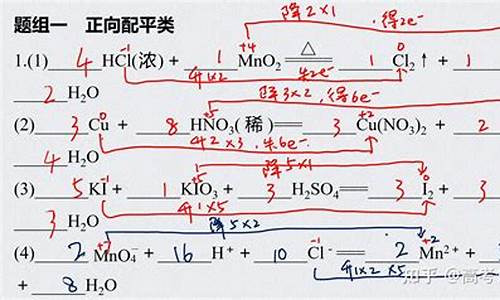
(1)氧化还原反应配平---得失电子法!
(2) FeSO4 + KMnO4 + H2SO4 ==> Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
(3)氧化反应 2FeSO4 + H2SO4 - 2 e- ==> Fe2(SO4)3 + 2H+ -------------------------*5
还原反应:2KMnO4 + 10e- + 3H2SO4 + 10H+ ==>
Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O----------------------------------------------*1
(4)氧化反应通乘以5!
10FeSO4 + 5H2SO4 - 10 e- ==> 5Fe2(SO4)3 + 10H+
2KMnO4 + 10e- + 3H2SO4 + 10H+ ==> K2SO4 + 2MnSO4 + 8H2O
(5)合并同类项
10FeSO4 + 5H2SO4 ==> 5Fe2(SO4)3
2KMnO4 + 3H2SO4 ==> K2SO4 + 2MnSO4 + 8H2O
(6)左加左 右加右 箭号变等号!
10FeSO4 + 2KMnO4 + 8H2SO4 == 5Fe2(SO4)3 +2KMnO4 + 2MnSO4 + 8H2O
氧化还原反应方程式配平
氧化还原反应是中学化学教学的重点和难点,而它的配平更使很多同学在学习时非常感到吃力。事实上,只要我们掌握一些特殊技巧,结合少量的练习,就可以做到对氧化还原反应的配平迎刃而解。下面本文分三个部分简单介绍氧化还原反应的配平原则、一般方法和特殊技巧。 一、配平原则 由于在氧化还原反应里存在着电子的转移,因此元素的化合价必然有升有降,我们把化合价能升高的元素或含该元素的物质称还原剂;反之称为氧化剂。由氧化还原反应的知识我们不难得出配平原则:还原剂失电子总数=氧化剂的电子总数,即还原剂(元素)化合价升高的总价数=氧化剂(元素)化合价降低的总价数。 二、氧化还原反应方程式配平的一般方法与步骤 1、一般方法:从左向右配。 2、步骤:标变价、找变化、求总数、配系数。即 ⑴ 标出变化元素化合价的始态和终态; ⑵ 始态 终态 变化的总价数 = 变化 × 系数 注:设以上变化均以正价表示,其中(b-a)×(d-c) 为最小公倍数。 ⑶ 将 上的系数,分别填在还原剂和氧化剂化学式的前面作为系数; ⑷ 用观察法配平其它元素; ⑸ 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看是否符合电荷守恒)例1、 C + HNO3(浓)- NO2 + CO2 + H2O 分析:⑴标变价 C(0) + HN(+5)O3(浓)- N(+4)O2 + C(+4)O2 + H2O ⑵ 找变化 始态 终态 变化的总价数 = 变化 × 系数 ⑶ 求总数 1 × 4 = 4 ⑷ 配系数 C 的系数为 1 HNO3的系数为 4 ,用观察法将其它系数配平后,经检查满足质量守恒定律。配平后的化学方程式为: C + 4 HNO3(浓)= 4 NO2 + CO2 + 2 H2O 三、氧化还原反应配平的特殊技巧。 1、从右向左配平法例2、Cu + HNO3(浓)- Cu(NO3)2 + NO2 + H2O 分析:由于HNO3在反应中有两个作用即酸性和氧化性,因此如按照一般的方法从左向右配的话比较麻烦,但如用从右向左配平法的方法,这个问题显得很简单。不同之处:配系数时只需将 中的系数先写在对应产物化学式之前,其它步骤相同。 始态 终态 变化的总价数 = 变化 × 系数 Cu + 4 HNO3(浓)= Cu(NO3)2 +2 NO2 + 2H2O 总结使用范围:此法最适用于某些物质(如硝酸、浓硫酸的反应)部分参加氧化还原反应的类型。 2、整体总价法(零价法)适用范围:在氧化还原反应中,一种反应物中有两种或两种以上的元素化合价发生变化或几种不同物质中的元素化合价经变化后同存在于一种产物中。技巧:把该物质当成一个“整体”来考虑。例3、FeS2 + O2 — Fe2O3 + SO2 分析:在FeS2 中Fe的化合价由+2变到+3,S的化合价由-1变到+4,即同一种物质中有两种元素的化合价同时在改变,我们可以用整体总价法,把FeS2当成一个“整体”来考虑。 故 4FeS2 +11 O2 =2 Fe2O3 +8 SO2 3、歧化归一法适用范围:同种元素之间的歧化反应或归一反应。技巧:第三种价态元素之前的系数等于另两种元素价态的差值与该价态原子数目的比值。例4、Cl2 + KOH — KCl + KClO + H2O 分析:在氧化还原反应中,电子转移只发生在氯元素之间,属于歧化反应。 0 -1 +5 Cl2 + KOH — KCl + KClO3 + H2O Cl2 的系数为6/2=3 KCl的系数为5 KClO3的系数为1 故 3Cl2 + 6KOH = 5KCl + KClO3 +3 H2O 4、判断未知物 顾名思义,在一个氧化还原反应中缺少反应物或生成物。 技巧:一般是把反应物和生成物中的所有原子进行比较,通过观察增加或减少了哪种元素: ①若增加的元素是除H、O以外的非金属,未知物一般是相应的酸; ②若增加的元素是金属,未知物一般是相应的碱; ③若反应前后经部分配平后发现两边氢、氧原子不平衡,则未知物是水。 例5、KMnO4 + KNO2 + — MnSO4 + K2SO4 + KNO3 + H2O 分析:经比较发现,生成物中增加了S元素,则未知物是H2SO4 ,其它步骤同上略。 2KMnO4 + 5KNO2 + 3 H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O 5、单质后配法适用范围:反应物或生成物中有单质参加或单质生成,如有机物的燃烧都可用此法。 技巧:把游离态的那种元素放在最后来配。 例6、FeS2 + O2 — Fe2O3 + SO2 分析:反应物中有单质O2 ,我们可以把O元素放在最后来配。首先定 Fe2O3的系数为1,则FeS2 的系数为2,那么SO2的系数为4,因此O2的系数为11/2,然后把每种物质前的系数都扩大2倍,即可配平。 4FeS2 +11 O2 =2 Fe2O3 +8 SO2 6、待定系数法 技巧:将各种物质的系数分别设为不同的未知数,然后根据质量守恒定律列方程求解最后配平。 7、加合法 技巧:把某个复杂的反应看成是某几个反应的叠加而成。 例7、Na2O2 + H2O — NaOH + O2 分析:我们可把这个反应看成是以下两个反应的叠加: Na2O2 + 2H2O = 2NaOH + H2O2 ① 2H2O2 = 2H2O + O2 ② 把①× 2+ ② ,最后我们得到:2Na2O2 +2 H2O = 4NaOH + O2 总结:从以上示例我们发现,对于同一氧化还原反应,有时可用不同的方法来配平,也有时用几种方法综合应用。总之,只要我们能掌握以上技巧,配平氧化还原反应方程式会易如反掌。
氧化还原反应方程式的配平
氧化还原反应方程式的配平:
配平步骤?:
标变价:写出反应物和生成物的化学式,标出变价元素的化合价。
列变化:列出反应前后元素化合价的升、降变化值。
求总数:使化价升高和降低的总数相等。
配系数:用观察的方法配平其他物质的化学计量数,配平后,把单线改成等号。
查守恒:检查方程式两边是否“质量守恒”和“电荷守恒”。
配平原则?:
反应前后各元素的原子个数相等,即质量守恒。
氧化剂得电子总数与还原剂失电子总数相等,即电子守恒。
氧化剂化合价降低的总数值与还原剂化合价升高的总数值相等。
配平氧化还原反应方程式的方法
配平氧化还原反应方程式的方法如下:
氧化还原反应方程式的配平是中学化学的难点之一。在中学阶段,氧化还原反应方程式的配平最常用的方法是化合价升降法,但对于一些复杂的氧化还原反应运用此方法进行配平时总感觉无从下手,正确率很低。
关氧化还原反应式的配平方法如下:
1、顺向配平法这类反应,以氧化剂和还原剂为基准分析配平,即从方程式的左端开始配平。
2、逆向配平法对自身氧化还原反应(包括歧化反应和同一物质中不同种元素间的反应)用逆向配平。
3、零价法此法适于某一反应物中几种元素在反应物中化合价都上升(或下降)的反应,以及一些不常见的化合物参加反应且较难确定该化合物中有关元素化合价的反应,在配平过程中可把这些元素的化合价人为地视为零价。
4、整体总价法。
5、缺项配平法所谓缺项方程式,即某些反应物或生成物的化学式未给出,它们一般为水、酸、碱。这类方程式的配平不仅要配平化学计量数,还要写出未知物的化学计量数,再通过比较反应物与生成物,观察增减的原子或离子数,确定未知物并配平。
6、待定系数法方法胡技巧是将各种物质的系数分别设为不同的未知数,然后根据质量守恒定律列方程求解最后配平。
7、氧化还原反应离子方程式的配平。
不同介质条件下配平氧原子数的经验规则:
1、酸性条件下反应式左边氧原子数多于右边,加氢离子;反应式左边氧原子数少于右边水。
2、碱性条件下反应式左边氧原子数多于右边,加水;反应式左边氧原子数少于右边加氢根。
3、中性条件下反应式左边氧原子数多于右边,加水;反应式左边氧原子数少于右边加水。
高中化学氧化还原反应配平问题
最佳答案检举 1.最简单的:可以根据原子守恒,就是反应前和反应后的原子总数相等,各个对应的原子数相等
2.最有效的:根据电子守恒(可以理解成化合价的升降),因为氧化还原反应的本质是电子的得失,有得电子必然有失电子,利用电子守恒做肯定对的。
说多了没用,我举例吧。
Cu+ HNO3= Cu(NO3)2+ NO2↑+ H2O
遇到这样一道题,我们先观察反应物谁降价,谁升价
Cu(0)-->Cu2+,,HNO3(+5)-->NO2(+4)
所以,Cu是失去电子,HNO3是得电子,根据电子守恒,NO2的系数应该是Cu的2倍,先写2.。。Cu+ HNO3= Cu(NO3)2+ 2NO2↑+ H2O (这时候Cu和NO2的系数确定了)
但是,注意的是,HNO3不但提供NO2的N,还提供了NO3-,所以根据原子守恒,HNO3的系数是2+2==4,推出H2O的是2
最终的配平是
Cu+ 4 HNO3= Cu(NO3)2+ 2 NO2↑+ 2 H2O
( )FeS2+( )HNO3=( )Fe(NO3)3+( )SO2+( )NO+( )H2O
关于这条方程式
我们先标一下他们化合价变化:
Fe从+2到+3(失去1e-),S从-1到+4(失去5e-)这两个都是还原剂
N从+5到+2(得到3e-),另外值得注意的是,HNO3除了提供NO的N原子外,还提供了NO3-的N原子,这一部分的HNO3不是作为氧化剂,而只是作为酸的,遇到两重作用的硝酸,反应物的系数一般由产物的系数反推的。
现在我们开始利用电子守恒,配平
Fe从+2到+3(失去1e-),S从-1到+4(失去5e-),所以1mol还原剂一共失去1+2×5=11mole-
N从+5到+2(得到3e-),1mol氧化剂得到3mole-,取最小公倍数,是33
所以,先给FeS2配3,NO配11,
再根据原子守恒,Fe(NO3)3配3,,SO2配6,所以推出HNO3的系数为3×3+11=20,HO2为10
所以最终的答案是
3FeS2+20HNO3=3Fe(NO3)3+6SO2+11NO+10H2O
最后用原子守恒检查一下









