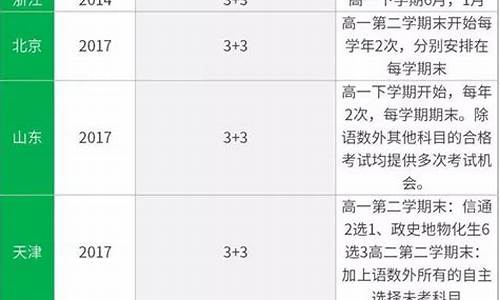
您现在的位置是: 首页 > 教育改革 教育改革
高中化学加热-高考化学加热
tamoadmin 2024-08-29 人已围观
简介1.用新制的Cu(OH)2鉴定醛基究竟要怎么加热2.一道化学题,下列溶液加热蒸干后,能析出溶质固体的是 A,AlCl3 B,KHCO33.高考有关硫的化学方程式要所有的4.高考化学与生活常考知识点用新制的Cu(OH)2鉴定醛基究竟要怎么加热检验醛基的试剂通常是新制氢氧化铜或者是银氨溶液,在鉴别过程中一定要考虑到溶液本身是呈现的碱性,所以在与氢氧化铜悬浊液反应后得到的是羧酸钠而不是羧酸,在历年高考中
1.用新制的Cu(OH)2鉴定醛基究竟要怎么加热
2.一道化学题,下列溶液加热蒸干后,能析出溶质固体的是 A,AlCl3 B,KHCO3
3.高考有关硫的化学方程式要所有的
4.高考化学与生活常考知识点
用新制的Cu(OH)2鉴定醛基究竟要怎么加热

检验醛基的试剂通常是新制氢氧化铜或者是银氨溶液,在鉴别过程中一定要考虑到溶液本身是呈现的碱性,所以在与氢氧化铜悬浊液反应后得到的是羧酸钠而不是羧酸,在历年高考中出现过这种类型的题图,或者分两步写,在写一步得到的羧酸与氢氧化钠的反应,或者直接写成一个整体的化学反应方程式,在反应物中要有氢氧化钠参与到反应中。
一道化学题,下列溶液加热蒸干后,能析出溶质固体的是 A,AlCl3 B,KHCO3
解:选C.
‍下列溶液加热蒸干后,能析出溶质固体的是? 的是解题方法:
首先对热不稳定的物质,比如碳酸的酸式盐,铵盐,硝酸盐等溶液加热蒸干后,不能析出溶质固体。
能够水解的盐,并且生成的酸是容易挥发的,比如AlCl3溶液加热蒸干后,不能析出溶质固体。因为AlCl3+3H2O=(可逆)=Al(OH)3+3HCl,由于HCl挥发溢出,所以析出的固体是氢氧化铝。
能够水解的盐,但是生成的酸是不容易挥发的,比如Fe2(SO4)3溶液加热蒸干后,由于H2SO4是难挥发性酸,仍然留在溶液中,加热相当于水被蒸发。能析出溶质固体。
高考有关硫的化学方程式要所有的
常见的化学方程式
作为氧化剂(发生还原反应,被还原)
Fe+S=加热=FeS
Hg+S==HgS
2Cu+S=加热=Cu2S
2Al+3S=加热=Al2S3
H2+S=加热 可逆=H2S
S+2KNO3+3C=点燃=K2S+3CO2↑+N2↑
作为还原剂(发生氧化反应被氧化)
S+O2=点燃=SO2
S+HNO3(稀) 不知道反应不反应。。。
S+6HNO3(浓)=加热=H2SO4+6NO2↑+2H2O
S+H2SO4(浓)=加热=3SO2↑+2H2O
2S+6KMnO4+2H2O=3K2MnO4+3MnO2+2H2SO4(据说会看到白雾,但应该不是硫酸酸雾吧。。。)
歧化反应
3S+6NaOH=加热=2Na2S+Na2SO3+3H2O
-2价 H2S Na2S Fe2S
还原剂(氧化反应被氧化)
2H2S+O2==2S+2H2O
2H2S+3O2(过量)=点燃=2SO2+2H2O
2H2S(过量)+O2=点燃=2S+2H2O
2H2S+SO2==3S+H2O
H2S+8HNO3(浓)==H2SO4+8NO2+4H2O
H2S+H2SO4(浓)==S↓+SO2+H2O
H2S+3H2SO4(浓,过量)=加热=4SO2+3H2O
H2S+Cl2==2HCl+S
H2S+2FeCl3==2FeCl2+S↓+4SO2
4NO2+H2S===4NO+SO3+H2O
+4价
氧化剂
2H2SO3+2H2S===3S↓+2H2O
还原剂(被氧化,氧化反应)
2SO2+O2=(加热,催化,可逆)=2SO3
SO2+2HNO3(浓)=加热=H2SO4+2NO2
3SO2(过量)+2HNO3(浓)=加热=H2SO4+2NO
SO2+X2+2H2O==H2SO4+2HX(X=Cl2 I2 Br2)
SO2+H2O+FeCl3==H2SO4+2FeCl2+2HCl
2SO2+2H2O+O2==2H2SO4
2H2SO3+O2==2H2SO4
+6价
氧化剂(还原反应被还原) 以下h2so4均为浓
2H2SO4(浓)+C=加热=CO2↑+2SO2↑+2H2O
2H2SO4(浓)+S=加热=3SO2↑+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2↑+6H2O
2H2SO4(浓)+Cu=加热=CuSO4+SO2↑+2H2O
常考点:
Cl2+SO2 +2H2O===H2SO4 +2HCl
S+6HNO3(浓)===H2SO4+6NO2↑+2H2O
3S+4 HNO3(稀)===3SO2+4NO↑+2H2O
2H2S+SO2===3S↓+2H2O
H2S+CuCl2===CuS↓+2HCl
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+H2O===H2SO3
SO3+H2O===H2SO4
HClO+H2SO3===H2SO4+HCl
H2SO4(浓)+2HBr===SO2↑+Br2↑+2H2O
H2SO4(稀)+Fe===FeSO4+H2
H2SO3+X2+H2O===H2SO4+2HX (X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
H2SO4(浓) +CaF2===CaSO4+2HF↑
H2SO4(浓)+NaCl===NaHSO4+HCl↑
H2SO4(浓) +2NaCl===Na2SO4+2HCl↑
H2SO4(浓)+NaNO3===NaHSO4+HNO3
2NaOH+SO2(少量)===Na2SO3+H2O
NaOH+SO2(足量)===NaHSO3
NaOH+H2S(足量)===NaHS+H2O
2NaOH+H2S(少量)===Na2S+2H2O
2FeCl3+H2S===2FeCl2+2HCl+S↓
3Na2S+8HNO3(稀)===6NaNO3+2NO↑+3S↓+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O
2Na2SO3+O2===2Na2SO4
Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O
高考化学与生活常考知识点
鱼一跃便成龙,大鹏展翅震长空,善于整理化学的知识点助你高考更加顺利。下面是我整理的高考化学与生活常考知识点,供大家参考!
高考化学常考知识点
1.碱金属元素原子半径越大,熔点越高,单质的活泼性越大
错误,熔点随着原子半径增大而递减
2.硫与白磷皆易溶于二硫化碳、四氯化碳等有机溶剂,有机酸则较难溶于水
错误,低级有机酸易溶于水
3.在硫酸铜饱和溶液中加入足量浓硫酸产生蓝色固体
正确,浓硫酸吸水后有胆矾析出
4.能与冷水反应放出气体单质的只有是活泼的金属单质或活泼的非金属单质
错误,比如2Na2O2+2H2O=O2↑+4NaOH
5.将空气液化,然后逐渐升温,先制得氧气,余下氮气
错误,N2的沸点低于O2,会先得到N2,留下液氧
6.把生铁冶炼成碳素钢要解决的主要问题是除去生铁中除Fe以外各种元素,把生铁提纯
错误,是降低生铁中C的百分比而不是提纯
7.虽然自然界含钾的物质均易溶于水,但土壤中K%不高,故需施钾肥满足植物生长需要
错误,自然界钾元素含量不低,但以复杂硅酸盐形式存在难溶于水
8.制取漂、配制波尔多液以及改良酸性土壤时,都要用到熟石灰
正确,制取漂为熟石灰和Cl2反应,波尔多液为熟石灰和硫酸铜的混合物
9.二氧化硅是酸性氧化物,它不溶于酸溶液
错误,SiO2能溶于氢氟酸
10.铁屑溶于过量盐酸,再加入氯水或溴水或碘水或硝酸锌,皆会产生Fe3+
错误,加入碘水会得到FeI2,因为Fe3+的氧化性虽然不如Cl2,Br2,但是强于I2,在溶液中FeI3是不存在的,共有3mol电子发生转移?
11.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
错误,钝化是化学性质,实质上是生成了致密的Al2O3氧化膜保护着铝罐
12.NaAlO2、Na2SiO3、Na2CO3、Ca(ClO)2、NaOH、C17H35COONa、C6H5ONa等饱和溶液中通入CO2出现白色沉淀,继续通入CO2至过量,白色沉淀仍不消失
错误,Ca(ClO)2中继续通入CO2至过量,白色沉淀消失,最后得到的是Ca(HCO3)2
13.大气中大量二氧化硫来源于煤和石油的燃烧以及金属矿石的冶炼
正确
14.某澄清溶液由NH4Cl、AgNO3、NaOH三种物质混合而成,若加入足量硝酸必产生白色沉淀
正确,NH4Cl、AgNO3、NaOH混合后发生反应生成[Ag(NH3)2]+加入足量硝酸后生成AgCl和NH4NO3
15.为了充分利用原料,硫酸工业中的尾气必须经净化、回收处理
错误,是为了防止大气污染
16.用1molAl与足量NaOH溶液反应
正确
17.硫化钠既不能与烧碱溶液反应,也不能与氢硫酸反应?
错误,硫化钠可以和氢硫酸反应:?Na2S+H2S====2NaHS?
18.在含有较高浓度的Fe3+的溶液中,SCN-、I-、AlO2-、S2-、CO32-、HCO3-等不能大量共存?
正确,Fe3+可以于SCN-配合,与I-和S2-发生氧化还原反应,与CO32-,HCO3-和AlO2-发生双水解反应?
19.活性炭、二氧化硫、氯水等都能使品红褪色,但反应本质有所不同?
正确,活性炭是吸附品红,为物理变化,SO2是生成不稳定的化合物且可逆,氯水是发生氧化还原反应且不可逆?
20.乙酸乙酯、三溴苯酚、乙酸钠、液溴、玻璃、重晶石、重钙等都能与烧碱反应?
错误,重晶石(主要成分BaSO4)不与烧碱反应?
21.在FeBr2溶液中通入一定量Cl2可得FeBr3、FeCl2、Br2?
错误,Fe2+和Br2不共存?
22.由于Fe3+和S2-可以发生氧化还原反应,所以Fe2S3不存在?
错误,在PH=4左右的Fe3+溶液中加入Na2S可得到Fe2S3,溶度积极小?
23.在次氯酸钠溶液中通入少量二氧化硫可得亚硫酸钠与次氯酸?
错误,次氯酸可以氧化亚硫酸钠,会得到NaCl和H2SO4?
24.有5.6g铁与足量酸反应转移电子数目为0.2NA?
错误,如果和硝酸等强氧化性酸反应转移0.3NA?
25.含有最高价元素的化合物不一定具有强氧化性?
正确,如较稀的HClO4,H2SO4等?
26.单质的还原性越弱,则其阳离子的氧化性越强?
错误,比如Cu的还原性弱于铁的,而Cu2+的氧化性同样弱于Fe3+?
27.CuCO3可由Cu2+溶液中加入CO32-制得?
错误,无法制的纯净的CuCO3,Cu2+溶液中加入CO32会马上有Cu2(OH)2CO3生成?
28.单质X能从盐的溶液中置换出单质Y,则单质X与Y的物质属性可以是:(1)金属和金属;(2)非金属和非金属;(3)金属和非金属;(4)非金属和金属;?
错误,(4)非金属和金属不可能发生这个反应
29.H2S、HI、FeCl2、浓H2SO4、Na2SO3、苯酚等溶液在空气中久置因发生氧化还原反应而变质
错误,H2SO4是因为吸水且放出SO3而变质
30.浓硝酸、浓硫酸在常温下都能与铜、铁等发生反应
错误,浓硫酸常温与铜不反应
高中化学知识的趣味记忆法
一、歌诀记忆法
歌诀记忆法就是针对需要记忆的化学知识利用音韵编成,融知识性与趣味性于一体,读起来朗朗上口,利记易诵。如从细口瓶中向试管中倾倒液体的操作歌诀:“掌向标签三指握,两口相对视线落。”“三指握”是指持试管时用拇指、食指、中指握紧试管;“视线落”是指倾倒液体时要观察试管内的液体量,以防倾倒过多。再如氨氧化法制硝酸可编如下歌诀:“加热催化氨氧化、一氨化氮水加热;一氧化氮再氧化,二氧化氮呈棕色;二氧化氮溶于水,要制硝酸就出来”。
象元素符号、化合价、溶解性表等都可以编成歌诀来进行记忆。歌诀在教与学的过程中确实可以用来帮助记忆,使你轻松愉快地巩固学习成果。
二、谐音记忆法
谐音记忆法就是要把需要记忆的化学内容跟日常生活中的谐音结合起来进行记忆。如地壳中各元素的百分含量前三位是“氧、硅、铝”,可谐北方音为“养闺女”。再如,金属活动顺序为:钾、钙、钠、镁、铝、锰、锌、铁;锡、铅、铜、汞、银、铂、金可谐音为:“加个那美丽的新的锡铅统共一百斤。”
三、会意记忆法
会意记忆法就是把一些抽象的概念进行自我理解和再加工处理,然后去巧记。如氢气或一氧化碳还原氧化铜的实验操作是:实验开始时,先通气后加热,实验结束时,先停止加热后停止通气,因此可会意记作,“气体早出晚归,酒精灯迟到早退。”再如把四种基本反应类型分别会意成“一分为二”(分解反应)“合二为一”(化合反应)、“取而代之”(置换反应)、“相互交换”(复分解反应)。
形象比喻记忆法就是借助于形象生动的比喻,把那些难记的概念形象化,用直观形象去记忆。如核外电子的排布规律是:“能量低的电子通常在离核较近的地方出现的机会多,能量高的电子通常在离核较远的地方出现的机会多。”这个问题是比较抽象的,不是一下子就可以理解的。
四、联想记忆法
联想记忆法就是把一些化学实验或概念用联想的 方法 进行记忆。联想法是带有验证性的 记忆方法 ,是新旧知识建立联系的产物。在化学教学过程中应抓住问题特征,由此及彼发展联想。如记忆氢气、碳、一氧化碳还原氧化铜的实验过程可用实验联想,对比联想,再如将单质与化合物两个概念放在一起来记忆:“由同(不同)种元素组成的纯净物叫做单质(化合物)。
对于文字较少而又零乱的难以记忆的小问题要抓住关键字词进行奇特联想,如氢氧化钠的用途是:用于肥皂、石油、造纸、纺织、印染等工业上,可记为:“纸(织)上染了肥油”。
五、浓缩记忆法
浓缩记忆法就是针对一类化学知识或规律在深刻理解的基础上,可选取有代表性的字或词缩略成提纲挈须的骨架进行记忆。如实验室制氧气的七个实验步骤记为;“检、装、夹、点、收、移、熄。”“检”指检查装置是否漏气;“装”指往试管里装药品;“夹”指把试管夹在铁架台上;“点”指点燃酒精灯;“收”指收集气体;“移”指把导管先移出水面;“熄”指熄灭酒精灯。再如过滤操作中的注意点浓缩为:“一贴、二低、三靠”。
六、猜谜记忆法
猜谜记忆法就是把一些化学知识编成富有知识性、趣味性、生动形象幽默的 谜语 进行记忆。如记忆一氧化碳性质的谜语是:”左侧月儿弯,右侧月儿圆,弯月能取暖,圆月能助燃,有毒无色味,还原又可燃。”
七、形象比喻记忆法
如果我们打这样个比方就可以理解了,也易于记忆了。把地球比作原子核,把能力高的大雁、老鹰等鸟比作能量高的电子,把能力低的麻雀、小燕子等鸟比作能量低的电子。能力高的鸟常在离地面较高的天空飞翔,能力低的鸟常在离地面很低的地方活动。再如有机化学烯烃中有双键,易发生加成反应和聚合反应,乙烯发生聚合反应时生成聚乙烯,可形象地运用手插尹“C=C”和手拉手“-C-C-”作比喻,这样较易记祝总之,趣味记忆的方法很多,诸如图示记忆、归纳记忆、借曲填词记忆等。
在教与学的过程中可根据实际情况, 总结 适合于自己的记忆方法。只要记得快。
记得准,记得牢,就不失为一种好的记忆方法。
高中化学易错知识点总结
1、多元含氧酸具体是几元酸看酸中H的个数
多元酸究竟能电离多少个H+,是要看它结构中有多少个羟基,非羟基的氢是不能电离出来的。如亚磷酸(H3PO3),看上去它有三个H,好像是三元酸,但是它的结构中,是有一个H和一个O分别和中心原子直接相连的,而不构成羟基。构成羟基的O和H只有两个。因此H3PO3是二元酸。当然,有的还要考虑别的因素,如路易斯酸H3BO3就不能由此来解释。
2、酸式盐溶液呈酸性
表面上看,“酸”式盐溶液当然呈酸性啦,其实不然。到底酸式盐呈什么性,要分情况讨论。如果这是强酸的酸式盐,因为它电离出了大量的H+,而且阴离子不水解,所以强酸的酸式盐溶液一定呈酸性。而弱酸的酸式盐,则要比较它电离出H+的能力和阴离子水解的程度了。如果阴离子的水解程度较大(如NaHCO3),则溶液呈碱性;反过来,如果阴离子电离出H+的能力较强(如NaH2PO4),则溶液呈酸性。
3、H2SO4有强氧化性
就这么说就不对,只要在前边加一个“浓”字就对了。浓H2SO4以分子形式存在,它的氧化性体现在整体的分子上,H2SO4中的S+6易得到电子,所以它有强氧化性。而稀H2SO4(或SO42-)的氧化性几乎没有(连H2S也氧化不了),比H2SO3(或SO32-)的氧化性还弱得多。这也体现了低价态非金属的含氧酸根的氧化性比高价态的强,和HClO与HClO4的酸性强弱比较一样。所以说H2SO4有强氧化性时必须严谨,前面加上“浓”字。
4、书写离子方程式时不考虑产物之间的反应
从解题速度角度考虑,判断离子方程式的书写正误时,可以“四看”:一看产物是否正确;二看电荷是否守恒;三看拆分是否合理;四看是否符合题目限制的条件。从解题思维的深度考虑,用联系氧化还原反应、复分解反应等化学原理来综合判断产物的成分。中学典型反应:低价态铁的化合物(氧化物、氢氧化物和盐)与硝酸反应;铁单质与硝酸反应;+3铁的化合物与还原性酸如碘化氢溶液的反应等。
5、忽视混合物分离时对反应顺序的限制
混合物的分离和提纯对化学反应原理提出的具体要求是:反应要快、加入的过量试剂确保把杂质除尽、选择的试剂既不能引入新杂质又要易除去。
6、计算反应热时忽视晶体的结构
计算反应热时容易忽视晶体的结构,中学常计算共价键的原子晶体:1 mol金刚石含2 mol 碳碳键,1 mol二氧化硅含4 mol硅氧键。分子晶体:1 mol分子所含共价键,如1 mol乙烷分子含有6 mol碳氢键和1 mol碳碳键。
7、对物质的溶解度规律把握不准
物质的溶解度变化规律分三类:第一类,温度升高,溶解度增大,如氯化钾、硝酸钾等;第二类,温度升高,溶解度增大,但是增加的程度小,如氯化钠;第三类,温度升高,溶解度减小,如气体、氢氧化钠等,有些学生对气体的溶解度与温度的关系理解不清。
高考化学与生活常考知识点相关 文章 :
1. 总结高考化学理综第7题知识
2. 高考化学与生活常考知识点
3. 高中化学化学与生活知识点
4. 浙江化学高考化学与生活知识点
5. 高考化学知识点的总结和归纳
6. 高考化学考点知识归纳
7. 总结高考化学必考知识点
8. 化学高三复习所有基础知识点汇总
9. 高中化学知识点总结